Історія.
Сульфатна кислота (або стара назва — купоросне масло) була
відома з давніх часів. Перші згадки про неї можна знайти в текстах алхіміка
Джабіра ібн Хайяна 8-го століття. Застаріла назва походить від застарілої назви
мінералів з яких вона отримувалася — купороси. Перші наукові дослідження, за
допомогою сірчаної кислоти провів Йоганн Рудольф Ґляубер. Він провів реакцію
між сірчаною кислотою і сіллю та отримавсоляну кислоту і сіль яка була названа
на його честь — глауберова сіль . Методи, у яких були використані сульфати,
були дуже складними і дорогими. Для отримання великих кількостей цієї речовини,
в 18-му столітті, розробили процес, в якому було використовувалося спалення
сірки і селітри у скляній тарі. Так як скляні посудини були дуже крихкими, то
перша реакція була проведена в 1746 році Джоном Робаком, у свинцевих
контейнерах. Сірчана кислота створених процесом Джона Робака мала концентрацію
тільки 35-40%. Пізніше поліпшення методу, французьким хіміком Жозефом Луї
Гей-Люссаком і англійськім Джоном Гловером, дало вихід речовини 78%
концентрації. Тим не менше, виробництво деяких барвників та інших хімічних
речовин вимагають більш концентрований продукт. Протягом 18-го століття,
сірчана кислота отримувалася сухою перегонкою мінералів, процес схожий на
оригінальні алхімічні процеси. Пірит (дисульфід заліза, FeS2) нагрівали в
повітрі для отримання заліза(II)сульфат, FeSO4, який окислюється при подальшому
нагріванні до заліза(III)сульфат Fe2(SO4)3, який, при нагріванні до 480 ° С,
розкладається до заліза(III)оксид і триоксида сірки, який може бути
використаний для отримання сірчаної кислоти в будь-якої концентрації. У 1831
році британський купець Перегрін Філліпс запатентував контактний процес, який
був набагато більш економічний. Сьогодні, майже вся сірчана кислота у світі
виробляється з використанням цього методу.
Знаходження в природі.
Земля
Вільна сірчана кислота зустрічається в природі дуже рідко. В
атмосфері вона утворюється з діоксиду сірки, який утворюється при згоранні
сірковмісних речовин або вулканічних вивержень. Діоксид сірки окислюється
гідроксильними радикалами такиснем з утворенням триоксиду сірки, який вступаючи
в реакцію з атмосферною вологою утворює кислоту. У кислотних дощах вона
виступає в розбавленому виді. Невелику кількість вільної сірчаної кислоти також
можна знайти в деяких вулканічних джерелах, які називаються сольфатари.
Найбільшу кількість сірчаної кислоти у світі містить озеро в кратері вулкана Іджен
в Індонезії. На відміну від вільної кислоти, її солі, зокрема, сульфати,
зустрічається в природі набагато частіше. Існує багато різнихмінералів
сульфатів. Серед них найвідомішими й найважливішими є гіпс (CaSO4 • 2 H2O),
барит (BaSO4), Халькантит (CuSO4 • 5 H2O) і глауберова сіль(Na2SO4 • 10 H2O).
Знаходження поза межами землі
ірчана кислота знаходиться за межами Землі в верхніх шарах
атмосфери Венери. Вона утворюється в результаті фотохімічних реакційдіоксиду
сірки і води, які утворюють краплі 80-85% кислоти. У більш глибоких шарах,
кислота розпадається через високі температури знову надіоксид сірки, і воду,
які піднімаючись догори знову можуть утворювати сірчану кислоту. Інфрачервоні спектри які були отримані апаратом
Галілео показують різні ступені поглинань на супутнику Юпітера, які були
віднесені до одного або кількох видів гідратів сульфатної кислоти.
Виробництво
Сировиною для виробництва сірчаної кислоти є елементарна
сірка яку отримують в величезних кільскостях на нафто- та газовопереробних заводах,
з сірководню, за допомогою процесу, який відомий як процес Клауса. Потім сірку
оксилюють до діоксиду сірки:
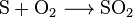
Реакція сірки з киснем
Ще одним джерелом діоксиду сірки є виплавлення руд, що
містять сірку. Прикладами є мідні, цинкові і свинцові сульфіди. Діоксид сірки
утворюється при випаленні з киснемповітря.

Реакція під час випалу сульфіду цинку
У 1999 році в Європі було випалено близько 3 млн тонн піриту
для виробництва сульфатної кислоти. В Азії ця цифра більша, оскільки і запаси
його більші. Для бідних ресурсами країнах, які не мають ні сірки, ні
сульфідних руд, існує процес Мюллера-Кюне. В цьому процесі діоксид сірки
утворюється при випаленні гіпсу і вугілля в печі. Цей процес можна зробити
прибутковішим, якщо в піч додавати пісок і глину для утворення цементу як
побічного продукту. Для подальшого виробництва потребуєтьсясірчаний ангідрид. Прямої
реакції діоксиду сірки і кисню в триоксид сірки не існує, так як рівновага
лежить на стороні діоксиду сірки. Тому для проведення цієї реакції потрібні
каталізатори.
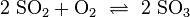
Окиснення діоксиду сірки до триоксиду
Триоксид сірки не розбавляється у воді відразу ж. Спочатку
його вводять у концентровану сірчану кислоту, цей розчин називають — олеумом.
Потім олеум розчиняють у воді до утворення сірчаної кислоти.

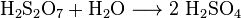
Фізичні властивості
Хімічні властивості
Сульфатна кислота руйнує також багато органічних речовин,
зокрема вуглеводи — дерево, папір, бавовняні тканини, цукор тощо. Руйнування
цих речовин обумовлюється тим, що концентрована сульфатна кислота віднімає від
них водень і кисень у вигляді води, а вуглець залишається у вигляді пористого
вугілля. При дії розведеної сульфатної кислоти на метали, які у
електрохімічному ряді активності металів розташовані ліворуч водню, виділяється
водень. Концентрована сірчана кислота має сильний окислювальний ефект і здатна
реагувати, при нагріванні, навіть з благородними металами, такими як мідь,
ртуть і срібло, хоча при цьому вона не взаємодіє з залізом. Тому для
перевезення концентрованої сульфатної кислоти використовуються залізні
цистерни.
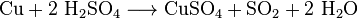

Комментариев нет:
Отправить комментарий